CDH17靶点“黄金赛道”浮现!维立志博双线并进卡位TCE+ADC
来源:网络 2025-03-30 10:16
作为实体瘤治疗领域的新兴靶点,CDH17正以双抗、三抗、ADC等多赛道并行的姿态掀起研发浪潮。
日前,美国癌症研究协会(AACR)公布了2025年会研究摘要,来自中国的创新药超过200款,涵盖ADC、双抗/多抗、小分子等多种药物形式,新靶点也大量涌现。在众多新靶点中,消化道肿瘤的CDH17靶点最为热门,仅ADC领域相关研究就多达11项,华东医药、先声药业、乐普生物等10余家药企纷纷入局,去年11月递表港交所的创新药企维立志博更是TCE+ADC双赛道布局。CDH17为何如此火爆?时间回拨到2022年3月,《Nature Cancer》上发表的一项研究首次证实CDH17可作为胃肠道癌及神经内分泌肿瘤的CAR-T治疗理想靶点,并通过体外模型验证其肿瘤杀伤特异性,让CDH17迅速成为业内宠儿。
CDH17是一种非经典的钙粘蛋白,在胚胎发育过程中主要在胎儿肝脏及胃肠道中表达,因此得名。CDH17在肝癌、胃癌、胰腺导管癌、结直肠癌等多种胃肠道肿瘤以及胰腺神经内分泌瘤、中肠和后肠神经内分泌瘤等分化良好的神经内分泌肿瘤中过度表达,且在成人正常组织中的表达仅限于小肠和结肠上皮细胞粘膜层与细胞间的紧密连接处,不易被血液循环系统触及,因此,CDH17 被视为潜在的肿瘤治疗靶点,尤其在胃肠道癌症和神经内分泌肿瘤的免疫治疗中备受关注。
从“小众”到“明星”:CDH17解锁ADC、双抗等多种疗法
尽管实体瘤是所有癌症中数量最多的,CAR-T疗法在血液肿瘤中取得的巨大成功仍然由于抗原特异性/异质性、细胞迁移不良、肿瘤微环境免疫抑制等种种限制无法在实体瘤治疗中扩展。且因其制造过程复杂、高度个性化且耗时,治疗费用也非常高昂,限制了药物的可及性,从而阻碍了它的商业成功。例如,Kymriah的单次输注费用为475,000美元,Yescarta则为373,000美元,且不包括住院治疗副作用的费用,对患者个人和医疗系统都是沉重的财务负担。因此,各大药企纷纷转向疗效优越的“平替”,解锁CDH17靶点的ADC、双抗、三抗等多种疗法。
2025年1月初,百奥赛图宣布将一款治疗结直肠癌的新型ADC候选药物SOT109授权给Sotio,彼时靶点尚未公开。同年3月的World ADC London大会上终于揭开了SOT109的庐山真面目——CDH17 ADC,有效载荷是exatecan,DAR值为4。目前处于临床阶段的CDH17 ADC包括普众发现的AMT-676、瀚森的HS-20110、宜联的YL217等。此外,还有众多处于临床前阶段的CDH17 ADC,包括迈威生物的7MW4911、康诺亚的CM518、礼新医药的LM-002等。
以TCE技术见长的维立志博也没有放过CDH17 ADC这片蓝海。在2025 AACR年会摘要中,维立志博披露了其利用自主研发并具有知识产权的Linker-payload技术平台开发的新型靶向CDH17的ADC药物LBL-054-ADC。据报道,LBL-054-ADC的抗体部分在自主开发IgG1抗体的基础上进一步改造,具有高特异性,能够高结合CDH17抗原并快速内吞,同时去除了Fc功能来减少免疫毒性,并通过抗体工程改造精准控制药物抗体比值(DAR)为6,而非经典的DAR 8,以平衡有效性和安全性。payload选用了经临床验证的拓扑异构酶抑制剂类的小分子毒素,具有较高的活性、细胞透膜性、抗耐药性,使LBL-054-ADC有较好的旁观者效应,对一些耐药细胞系的动物模型也有很好的药效。而自主开发的Linker由稳定的偶联子、可裂解肽、亲水spacer组成,避免了ADC的可逆Michael加成反应,同时确保LBL-054-ADC有优秀的理化性质和药代性质,能在外周循环中保持很好的稳定性,在肿瘤部位快速释放payload。临床前研究表明,LBL-054-ADC在血浆中稳定性高,在体内模型中展现出强大的有效性和良好的安全性。
而维立志博发表的另一篇摘要中公布了一款靶向CDH17和CD3的双特异性T细胞衔接抗体LBL-054-CD3。摘要显示,LBL-054-CD3对CDH17具有高亲和力的同时不与其他CDH家族成员发生交叉反应。这一点已被体外实验数据证实,LBL-054-CD3介导的肿瘤细胞杀伤依赖于CDH17表达水平,同时对CDH17阴性细胞无细胞毒性作用。在体外和体内实验中,LBL-054-CD3均展现出显著的抗肿瘤活性。
这是继全球临床进度领先的GPRC5DxCD3 TCE(LBL-034)、全球首创CD19xBCMAxCD3三特异性TCE(LBL-051)、全球第二款进入临床阶段的MUC16xCD3(LBL-033)、LILRB4xCD3(LBL-043)后,维立志博披露的第5个TCE产品。据悉,LBL-054-CD3同样是应用维立志博自主研发并具有知识产权的技术平台LeadsBody™开发,该平台通过对TCE分子设计进行多样化修改,可精细调节TCE对CD3及肿瘤相关抗原的亲和力,从而在控制细胞因子释放及降低T细胞衰竭的同时有效激活T细胞。通过LeadsBody™平台量身定制的分子定位及空间排列能优化疗效与安全性之间的平衡,减少与毒性相关的治疗中断,延长治疗持续时间,提高患者的生活质量。从维立志博TCE产品矩阵、开发效率以及部分TCE产品已有的临床数据,似乎可以期待一下LBL-054-CD3进入临床研究后的表现。
同质化竞争激烈:首上市CDH17靶点药物花落谁家?
中国作为消化道肿瘤高发国家,CDH17的大热几乎是毫无悬念的,甚至有报道称其是下一个超越CLDN18.2的消化道肿瘤靶点。从同质化角度,目前CDH17靶点全球研发的第一梯队为ADC和双抗,谁将率先突破成为首个上市的CDH17靶点药物尚是未知数。
CDH17在ADC和双抗领域竞争格局
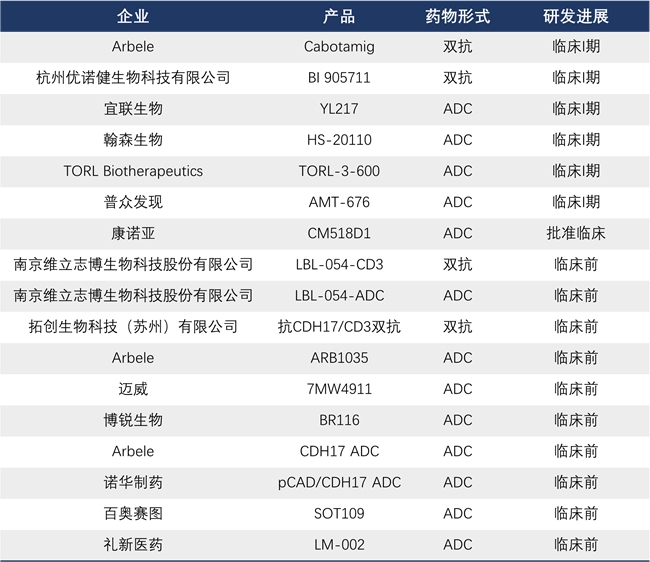
*以上为不完全统计
从上表进展来看,CDH17靶点药物研发即将驶入快车道,领先者已进入临床I期,紧随者则着力依托独特的技术平台、差异化分子、药物形式的布局选择以及临床研发策略,致力于弯道超车。例如,维立志博的TCE技术,差异化特色清晰,ADC管线虽然起步晚,但推进速度快,双抗与ADC的协同布局几乎覆盖了目前CDH17靶点全场景,有望在CDH17靶点争夺战中通过“高效率开发+组合拳战略” 弯道突围,在这片蓝海中抢占一席之地。

图:维立志博以IO为基础的ADC和TCE布局
总结
作为实体瘤治疗领域的新兴靶点,CDH17正以双抗、三抗、ADC等多赛道并行的姿态掀起研发浪潮——从比第一代TRAILR2激动剂效力提高近1000倍的TRAILR2/CDH17双抗,到众多CDH17 ADC药物的披露,多种技术路径竞速重塑实体瘤治疗格局,同时也将CDH17战场推向多维对抗时代,未来2年,且看谁能用临床数据讲出最硬核的靶点故事。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


